Doença Pulmonar Obstrutiva Crónica (DPOC)

A DPOC é uma doença pulmonar altamente prevalente e potencialmente fatal, que está entre as principais causas de mortalidade e incapacidade em todo o mundo. Contudo, o subdiagnóstico é frequente e subsistem muitas necessidades não satisfeitas no que diz respeito à sua gestão1-3.
PARTE 1
Compreender a DPOC
O que é a DPOC?
A doença pulmonar obstrutiva crónica (DPOC) é uma doença pulmonar comum que provoca uma obstrução do fluxo de ar e dificuldades respiratórias cada vez mais graves.
A Iniciativa Global para a Doença Pulmonar Obstrutiva Crónica (GOLD) define a DPOC como uma doença pulmonar heterogénea caracterizada por sintomas respiratórios crónicos devidos a anomalias das vias respiratórias e/ou dos alvéolos que causam uma obstrução persistente e frequentemente progressiva do fluxo de ar.3
Principais sintomas
Os sintomas incluem dispneia, tosse e produção de expetoração.
Embora a DPOC seja uma doença crónica, um número substancial de pacientes sofre de exacerbações agudas da DPOC (AEDPOC), que são definidas pela GOLD como um evento caracterizado por um aumento da dispneia e/ou tosse e expetoração que se agrava em menos de 14 dias, que pode ser acompanhado por taquipneia e/ou taquicardia e está frequentemente associado a um aumento da inflamação local e sistémica causada por infeção, poluição ou outro insulto às vias respiratórias.3
Os dados de várias coortes de pacientes indicam que cerca de 70% dos pacientes apresentam pelo menos uma AEDPOC durante um período de acompanhamento de 1-5 anos4.
A AEDPOC requer frequentemente cuidados urgentes, intensificação da medicação e/ou hospitalização, acarretando custos adicionais substanciais.5
Fisiopatologia
Pensa-se que a DPOC seja causada por uma mistura de fatores genéticos e ambientais, nomeadamente o tabagismo e a exposição à poluição (exposição profissional e poluição no interior resultante da queima de madeira e de outros combustíveis de biomassa)3.
Como a DPOC é uma doença heterogénea, um painel de especialistas recomenda que se classifique a DPOC com base nos mecanismos causais subjacentes, a fim de desenvolver abordagens de tratamento personalizadas.2
Impacto da doença
A DPOC representa um encargo económico1 e social considerável.6, 7
A DPOC afeta a qualidade de vida (QV) e o bem-estar mental dos pacientes: A DPOC está associada a uma condição física mais débil e a um estado de saúde característico da doença (em comparação com indivíduos sem DPOC),8 e a uma elevada incidência de comorbilidades psiquiátricas9 incluindo depressão10, 11.
A DPOC é a 3ª principal causa de mortalidade a nível mundial e a 7a principal causa de morbilidade12.
Os pacientes com DPOC correm o risco de hospitalizações frequentes, que estão associadas ao sofrimento emocional: cerca de 1 em cada 5 pacientes que frequentam o serviço de urgência é hospitalizado pelo menos uma vez no ano seguinte à sua visita inicial.13
As AEDPOC estão associadas ao declínio da função pulmonar14, à deterioração da qualidade de vida,15, 16 à diminuição da atividade física,17 à depressão,18 a novas hospitalizações, a novas AEDPOC e à mortalidade.19, 20
Comorbilidades
Existe uma elevada incidência de comorbilidades, nomeadamente cardiovasculares e diabetes3:
- As mais frequentes são a hipertensão, a doença arterial coronária, a diabetes, a osteoartrite, a doença psiquiátrica, a asma e a apneia obstrutiva do sono (AOS)21, 22
- As comorbilidades podem influenciar o estado clínico e o prognóstico do paciente e requerem tratamento: algumas doenças como a insuficiência cardíaca, a doença cardíaca isquémica, as perturbações do sono e a depressão/ansiedade estão associadas à AEDPOC.3, 23 A AOS pode agravar a hipoxemia noturna e aumentar o risco de hipertensão pulmonar22
Descondicionamento físico
Os pacientes com DPOC sofrem frequentemente de uma “espiral descendente” em termos de saúde: os efeitos sistémicos conduzem a comorbilidades cardiovasculares, perda de massa muscular e osteoporose, o que leva a uma maior inatividade e descondicionamento físico. Do mesmo modo, as exacerbações conduzem a uma diminuição da função pulmonar, à inatividade física e ao declínio da saúde mental.24
Compreender a DPOC: resumo

A DPOC é uma doença pulmonar progressiva que se manifesta principalmente por obstrução do fluxo de ar e está associada a uma diminuição da qualidade de vida dos pacientes e a um aumento do risco de mortalidade. Qual é a frequência da DPOC e como é que é diagnosticada?
PARTE 2
Prevalência e diagnóstico
Prevalência
As estimativas de prevalência variam, mas estima-se que vivam em todo o mundo cerca de 480 milhões de pessoas com DPOC25 e que a incidência tenha aumentado em mais de 85% entre 1990 e 2019,26 prevendo-se novos aumentos nas próximas décadas devido à exposição contínua a fatores de risco, ao envelhecimento da população e a uma maior sensibilização e diagnóstico.3
Diagnóstico
Os sinais e sintomas da DPOC podem variar entre pacientes e numa base diária. No entanto, deve considerar-se o diagnóstico em qualquer paciente com dispneia persistente e tosse crónica (intermitente ou contínua) com ou sem produção de expetoração e com historial de infeções recorrentes do trato respiratório inferior e/ou exposição a fatores de risco como o tabagismo ou a poluição.3
O método de diagnóstico de referência é a espirometria (mede a limitação das vias respiratórias que não é totalmente reversível com uma relação FEV1/FVC pós-broncodilatador <0,7), juntamente com o historial clínico e a presença de fatores de risco.3
As avaliações de apoio para excluir diagnósticos diferenciais podem incluir exames imagiológicos (radiografia do tórax ou TAC), gasimetria arterial (para detetar hipoxia/hipercapnia) e exame da expetoração (útil em pacientes que apresentam uma AEDPOC).3
Diagnóstico: necessidades não satisfeitas
À escala mundial, há uma grande variação na prevalência declarada da DPOC, com 10-95% dos pacientes subdiagnosticados, muitas vezes devido à utilização insuficiente ou inconsistente de métodos de diagnóstico ou à falta de disponibilidade,27
com alguns pacientes incapazes de aceder a instalações de diagnóstico ou a cuidados de saúde adequados.
Alguns especialistas salientaram várias deficiências nos atuais métodos e critérios de diagnóstico. A espirometria pós-broncodilatador não é preditiva de sintomas e não deteta alterações patológicas precoces. Além disso, a espirometria é frequentemente subutilizada ou mal interpretada. Um painel de especialistas sugere que a utilização de técnicas modernas de imagiologia, poderiam ser utilizadas para detetar a doença ligeira antes da ocorrência de alterações patológicas irreversíveis.2
Classificação da gravidade
Para orientar a abordagem do tratamento, a GOLD recomenda a classificação da DPOC por nível de obstrução ao fluxo de ar (GOLD 1-4) e por historial de sintomas/exacerbações3:
- O nível de obstrução ao fluxo de ar varia de ligeiro (GOLD 1) a muito grave (GOLD 4), em função do FEV1previsto
- A gravidade dos sintomas varia entre GOLD A (carga sintomática baixa: mMRC 0-1 ou CAT<10, historial de exacerbação baixo: ≤1 exacerbação moderada) e GOLD B (carga sintomática elevada: mMRC ≥2 ou CAT ≥10, historial de exacerbação baixo: ≤1 exacerbação moderada), e GOLD E (qualquer carga sintomática, risco de exacerbação elevado: ≥2 exacerbações moderadas ou ≥1 que leve a hospitalização)
Prevalência e diagnóstico: resumo

A DPOC é uma doença pulmonar heterogénea e altamente prevalente. Embora os sintomas possam ser variáveis, o padrão de referência para o diagnóstico é a relação FEV1/FVC pós-broncodilatador. O historial de exacerbações e o número de sintomas também são avaliados para determinar a gravidade da doença. Assim, como é que as classificações de gravidade são utilizadas para determinar a escolha do tratamento?
PARTE 3
Tratamento e prognóstico
Objetivos do tratamento
A escolha do tratamento da DPOC varia em função da gravidade da doença* e tem por objetivo aliviar os sintomas, reduzindo simultaneamente a progressão da doença, as exacerbações e a mortalidade.
As intervenções incluem mudanças no estilo de vida, terapia farmacológica e suporte de oxigénio/ventilação, como a oxigenoterapia de longa duração e a terapia de alto fluxo (Figura).
*O relatório da GOLD de 2023 para a DPOC reconhece três grupos de gravidade dos sintomas – “A”, “B” e “E”3.
Diretrizes
As informações contidas nas secções seguintes não se destinam a substituir as diretrizes locais nem as recomendações de sociedades especializadas. Consulte as diretrizes locais/internacionais mais recentes para tomar decisões sobre o tratamento. Algumas ligações relevantes são apresentadas em seguida:
https://goldcopd.org/2023-gold-report-2/
Modificação do comportamento/estilo de vida
As alterações comportamentais e do estilo de vida incluem deixar de fumar e reabilitação pulmonar (treino de exercício combinado com educação do paciente).
Ambas as estratégias demonstraram reduzir a mortalidade em pacientes com DPOC.3
Tratamentos farmacológicos
Os tratamentos farmacológicos podem reduzir os sintomas e a frequência e gravidade da AEDPOC, e melhorar o estado de saúde e a tolerância ao exercício.3
Os regimes devem ser individualizados com base na gravidade dos sintomas, no risco de exacerbação, nos efeitos secundários, nas comorbilidades do paciente e na disponibilidade/custo dos medicamentos, bem como na preferência do paciente.3
A GOLD recomenda os broncodilatadores inalados como fundamentais para a gestão dos sintomas. Estes medicamentos atuam para relaxar ou impedir a contração do músculo liso das vias respiratórias.3
Podem ser prescritos antibióticos aos pacientes durante, ou para prevenir, a AEDPOC28, 29 Os pacientes devem também ser vacinados para prevenir infeções que possam conduzir à AEDPOC.3
Os mucolíticos reduzem o risco de AEDPOC em alguns pacientes e são recomendados pela ERS/ATS para pacientes com limitação moderada ou grave do fluxo de ar e AEDPOC apesar da terapia inalatória otimizada.3, 29
Oxigenoterapia
A oxigenoterapia pode proporcionar alívio da hipoxemia e reduzir o esforço respiratório. A oxigenoterapia de longa duração deve ser reavaliada regularmente e é recomendada pela GOLD e pela ATS para pacientes com hipoxemia grave em repouso, nos quais está associado um pequeno aumento da taxa de sobrevivência.3, 30, 31
O oxigénio pode ser administrado através de um concentrador, de uma garrafa de oxigénio comprimido, de um reservatório com oxigénio líquido ou adicionado a um ventilador.
Terapia de Alto Fluxo (HFT)
A HFT fornece uma mistura de ar humidificado e aquecido, com ou sem O2, e pode beneficiar os pacientes com tosse crónica e produção de muco, sintomas que podem ser difíceis de gerir apenas com terapias convencionais.32
A HFT foi concebida para ser administrada através de uma cânula nasal de alto fluxo (NHFC). A HFT no domicílio pode fornecer um fluxo de 10-60l/min com adição de O2 possível de 10-15l/min. A configuração utilizada depende das necessidades do paciente.
Alguns dos benefícios da HFT incluem a gestão melhorada das secreções,33 diminuição da dispneia,34-36 redução do espaço morto,37 maior conforto para o paciente33, 37 e redução da AEDPOC.32, 38
Leia mais sobre a HFT aqui e os benefícios da HFT para os pacientes com DPOC aqui.
Ventilação não invasiva (VNI) domiciliária
A VNI é recomendada pela GOLD e pela ERS para pacientes estáveis com hipercapnia crónica grave e um historial de hospitalização por insuficiência respiratória aguda3, 39-41
- Os benefícios incluem a melhoria da sobrevivência e da qualidade de vida e a redução do risco de internamento hospitalar39, 40
- Após uma AEDPOC, foi demonstrado que a VNI combinada com a oxigenoterapia no domicílio prolonga significativamente o tempo até ao reinternamento ou morte e reduz novas situações de AEDPOC40 para além de ser eficaz em termos de custos42
- Os dados dos ensaios clínicos realçam a importância de avaliar cuidadosamente o fenótipo do paciente e o momento e a administração da VNI em casa para garantir a seleção dos pacientes com maior probabilidade de êxito43
Leia mais sobre as provas clínicas e a seleção de pacientes para a VNI domiciliária aqui
Melhores práticas da VNI domiciliária
As considerações sobre as melhores práticas de VNI domiciliária incluem a seleção rigorosa dos pacientes com maior probabilidade de beneficiar do tratamento, a administração de uma terapia que seja eficaz e bem tolerada e a monitorização rigorosa dos efeitos do tratamento.
A melhoria dos níveis elevados de dióxido de carbono arterial deve ser um dos principais objetivos da VNI domiciliária e os dados de ensaios clínicos mostram que pressões inspiratórias mais altas contribuem para o sucesso da terapia de VNI no domicílio.39, 40, 44
Leia mais sobre as melhores práticas da VNI domiciliária aqui
VNI para eventos agudos
A GOLD também recomenda a VNI para o tratamento da AEDPOC nos casos em que há acidose respiratória / dispneia grave com sinais clínicos que sugerem fadiga muscular respiratória / hipoxemia persistente apesar de O2 suplementar.3
A ERS/ATS recomenda a VNI para a insuficiência respiratória hipercápnica aguda ou crónica devida a AEDPOC.28
Custo-eficácia do tratamento com VNI em casa vs. no hospital
A VNI é particularmente eficaz em termos de custos quando iniciada no domicílio, comparativamente à VNI hospitalar (Figura).45
Em pacientes com hipercapnia persistente após uma AEDPOC com risco de vida, é provável que a terapia VNI + O2 em casa seja eficaz em termos de custos no Reino Unido (Quadro).
Escolha de OLD, HFT ou VNI
A OLD, a HFT e a VNI domiciliárias podem ser utilizadas separadamente ou em combinação para o tratamentode pacientes com DPOC. Algumas das vantagens de cada abordagem são apresentadas no quadro.
Pressão positiva contínua das vias aéreas (CPAP)
O CPAP também pode trazer benefícios a alguns pacientes, e tem demonstrado que melhora a taxa de sobrevivência e reduz o risco de hospitalização em pacientes com DPOC e apneia obstrutiva do sono3.
Cirurgia
As opções cirúrgicas incluem a redução do volume pulmonar, a bulectomia e o transplante pulmonar.
Prognóstico
Embora a DPOC seja uma doença progressiva, o tratamento adequado pode reduzir os sintomas, a frequência e a gravidade das exacerbações e melhorar o estado de saúde e a tolerância ao exercício3.
Alguns tratamentos podem também abrandar a taxa de declínio da função pulmonar e reduzir a mortalidade.3
Foi demonstrado que a oxigenoterapia de longa duração melhora a taxa de sobrevivência em pacientes com hipoxemia grave em repouso e que a VNI diminui a mortalidade e evita a necessidade de reinternamento em pacientes com hipercapnia crónica grave.3
A DPOC não tratada pode levar a uma insuficiência respiratória aguda ou crónica. Os pacientes estão particularmente em risco durante uma AEDPOC, uma vez que um aumento da obstrução das vias aéreas deixa o sistema respiratório vulnerável à sobrecarga.
Perspetivas futuras
É urgente fazer mais para combater a DPOC a nível mundial.46
Um painel de especialistas que escreve para a revista Lancet refere que uma resposta internacional coordenada (como foi o caso da COVID-19) pode derrubar as barreiras existentes ao tratamento e produzir resultados rápidos. Defendem, nomeadamente2:
- Estratégias de saúde pública para proibir o tabagismo e manter o ar limpo
- Uma abordagem de medicina personalizada – com base numa avaliação exaustiva da fisiopatologia e dos sintomas da doença, bem como das necessidades, capacidades e preferências dos pacientes
- Maior investimento em terapias curativas e regenerativas para ir além das opções de tratamento predominantemente sintomáticas
- Maior ênfase na AEDPOC que desempenha um papel crucial na progressão da doença e nos custos, mas que é tendencialmente definida de forma pouco precisa e insuficientemente investigada
Leia as infografias para explorar melhor algumas das principais necessidades não satisfeitas nos cuidados da DPOC;
Tratamento e prognóstico: resumo

A DPOC é uma doença progressiva que tem um impacto substancial na QV dos pacientes e é uma das principais causas de morbilidade e mortalidade em todo o mundo.3, 6, 12 No entanto, foi demonstrado que o tratamento adequado melhora os sintomas, a frequência e a gravidade da AEDPOC3, 32 e, em pacientes com DPOC e hipercapnia crónica tratados com ventilação não invasiva, melhora ainda a taxa de sobrevivência.39
A voz do especialista
Entrevista, Dr. Chris Carlin
Podem os modos automáticos e a telemonitorização apoiar e simplificar a titulação de VNI e os cuidados de boa qualidade na DPOC e na SOH?
Entrevista, Prof. Gonzalez-Bermejo
Como utilizar a VNI de alta intensidade em pacientes com DPOC no domicílio.
Recomendações práticas para a utilização da VNI domiciliária**
Estes vídeos acerca da utilização da VNI no domicílio destinam-se apenas a profissionais de saúde.
Continue a explorar

Doença neuromuscular (DNM)
A doença neuromuscular (DNM) é um termo abrangente que engloba muitas doenças e afeções que afetam a função muscular, quer diretamente (através de patologia muscular intrínseca) quer indiretamente (através de patologia nervosa).

Síndrome de Obesidade-Hipoventilação (SOH)
Saiba mais sobre esta doença – incluindo a sua prevalência, como é diagnosticada e as opções de tratamento disponíveis.

Notícias Clínicas sobre Respiração
A ResMed muda vidas com dispositivos médicos premiados e aplicações de software inovadoras baseadas na nuvem que diagnosticam, tratam e gerem os distúrbios respiratórios do sono (DRS), a doença pulmonar obstrutiva crónica (DPOC) e outras doenças respiratórias crónicas.
Este conteúdo destina-se apenas a profissionais de saúde.
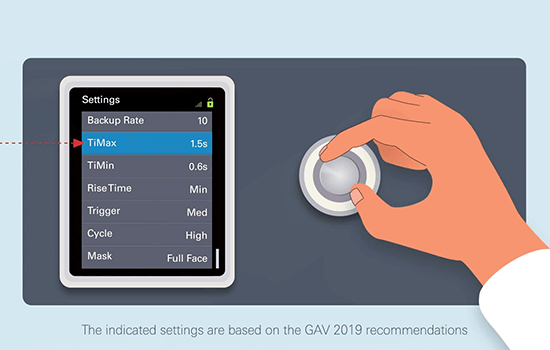
**Estes vídeos sobre a utilização da VNI no domicílio destinam-se apenas a profissionais de saúde e baseiam-se nas recomendações da GAV de 2019, que por sua vez se baseiam na literatura e nos contributos de experientes fisioterapeutas respiratórios. O protocolo de cuidados continua a ser da responsabilidade do médico que o prescreve e as definições do dispositivo devem ser definidas tendo em conta as necessidades de cada paciente.
Referências
- Iheanacho, I., et al., Economic Burden of Chronic Obstructive Pulmonary Disease (COPD): A Systematic Literature Review. Int J Chron Obstruct Pulmon Dis, 2020. 15: p. 439-460.
- Stolz, D., et al., Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet, 2022. 400(10356): p. 921-972.
- Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Prevention, Diagnosis and Management of COPD: 2023 Report 2023. Available at https://goldcopd.org/2023-gold-report-2/
- Hoogendoorn, M., et al., Prediction models for exacerbations in different COPD patient populations: comparing results of five large data sources. Int J Chron Obstruct Pulmon Dis, 2017. 12: p. 3183-3194.
- Dalal, A.A., et al., Impact of COPD Exacerbation Frequency on Costs for a Managed Care Population. J Manag Care Spec Pharm, 2015. 21(7): p. 575-83.
- Svedsater, H., et al., Life Impact and Treatment Preferences of Individuals with Asthma and Chronic Obstructive Pulmonary Disease: Results from Qualitative Interviews and Focus Groups. Adv Ther, 2017. 34(6): p. 1466-1481.
- Cook, N.S., et al., Patients’ perspectives on COPD: findings from a social media listening study. ERJ Open Res, 2019. 5(1).
- Franssen, F.M.E., et al., The physical, mental, and social impact of COPD in a population-based sample: results from the Longitudinal Aging Study Amsterdam. NPJ Prim Care Respir Med, 2018. 28(1): p. 30.
- FitzGerald, J.M., et al., Resource use study in COPD (RUSIC): a prospective study to quantify the effects of COPD exacerbations on health care resource use among COPD patients. Can Respir J, 2007. 14(3): p. 145-52.
- Omachi, T.A., et al., Depression and health-related quality of life in chronic obstructive pulmonary disease. Am J Med, 2009. 122(8): p. 778 e9-15.
- Zhang, M.W., et al., Prevalence of depressive symptoms in patients with chronic obstructive pulmonary disease: a systematic review, meta-analysis and meta-regression. Gen Hosp Psychiatry, 2011. 33(3): p. 217-23.
- GBD 2019 Diseases and Injuries Collaborators, Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet, 2020. 396(10258): p. 1204-1222.
- Yeatts, K.B., et al., Population-based burden of COPD-related visits in the ED: return ED visits, hospital admissions, and comorbidity risks. Chest, 2013. 144(3): p. 784-793.
- Donaldson, G.C., et al., Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax, 2002. 57(10): p. 847-52.
- Miravitlles, M., et al., Effect of exacerbations on quality of life in patients with chronic obstructive pulmonary disease: a 2 year follow up study. Thorax, 2004. 59(5): p. 387-95.
- Seemungal, T.A., et al., Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med, 1998. 157(5 Pt 1): p. 1418-22.
- Ehsan, M., et al., A longitudinal study evaluating the effect of exacerbations on physical activity in patients with chronic obstructive pulmonary disease. Ann Am Thorac Soc, 2013. 10(6): p. 559-64.
- Alahmari, A.D., et al., Physical activity and exercise capacity in patients with moderate COPD exacerbations. Eur Respir J, 2016. 48(2): p. 340-9.
- Suissa, S., S. Dell’Aniello, and P. Ernst, Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax, 2012. 67(11): p. 957-63.
- Connors, A.F., Jr., et al., Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med, 1996. 154(4 Pt 1): p. 959-67.
- Santos, N.C.D., et al., Prevalence and Impact of Comorbidities in Individuals with Chronic Obstructive Pulmonary Disease: A Systematic Review. Tuberc Respir Dis (Seoul), 2022. 85(3): p. 205-220.
- Soler, X., et al., High Prevalence of Obstructive Sleep Apnea in Patients with Moderate to Severe Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc, 2015. 12(8): p. 1219-25.
- Stallberg, B., et al., Real-world retrospective cohort study ARCTIC shows burden of comorbidities in Swedish COPD versus non-COPD patients. NPJ Prim Care Respir Med, 2018. 28(1): p. 33.
- Hurst, J.R., et al., Understanding the impact of chronic obstructive pulmonary disease exacerbations on patient health and quality of life. Eur J Intern Med, 2020. 73: p. 1-6.
- Boers, E., et al. An estimate of the global COPD prevalence in 2050: Disparities by income and gender. Poster presented at the European Respiratory Society International Congress 2022. Barcelona, Spain.
- Li, H.Y., et al., Global, regional and national burden of chronic obstructive pulmonary disease over a 30-year period: Estimates from the 1990 to 2019 Global Burden of Disease Study. Respirology, 2023. 28(1): p. 29-36.
- Ho, T., et al., Under- and over-diagnosis of COPD: a global perspective. Breathe (Sheff), 2019. 15(1): p. 24-35.
- Wedzicha, J.A.E.C.-C., et al., Management of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 49(3).
- Wedzicha, J.A., et al., Prevention of COPD exacerbations: a European Respiratory Society/American Thoracic Society guideline. Eur Respir J, 2017. 50(3).
- Jacobs, S.S., et al., Home Oxygen Therapy for Adults with Chronic Lung Disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med, 2020. 202(10): p. e121-e141.
- Cranston, J.M., et al., Domiciliary oxygen for chronic obstructive pulmonary disease. Cochrane Database Syst Rev, 2005. 2005(4): p. CD001744.
- Storgaard, L.H., et al., Long-term effects of oxygen-enriched high-flow nasal cannula treatment in COPD patients with chronic hypoxemic respiratory failure. Int J Chron Obstruct Pulmon Dis, 2018. 13: p. 1195-1205.
- Hasani, A., et al., Domiciliary humidification improves lung mucociliary clearance in patients with bronchiectasis. Chron Respir Dis, 2008. 5(2): p. 81-6.
- Cirio, S., et al., Effects of heated and humidified high flow gases during high-intensity constant-load exercise on severe COPD patients with ventilatory limitation. Respir Med, 2016. 118: p. 128-132.
- Neunhauserer, D., et al., Supplemental Oxygen During High-Intensity Exercise Training in Nonhypoxemic Chronic Obstructive Pulmonary Disease. Am J Med, 2016. 129(11): p. 1185-1193.
- Chatila, W., et al., The effects of high-flow vs low-flow oxygen on exercise in advanced obstructive airways disease. Chest, 2004. 126(4): p. 1108-15.
- Fraser, J.F., et al., Nasal high flow oxygen therapy in patients with COPD reduces respiratory rate and tissue carbon dioxide while increasing tidal and end-expiratory lung volumes: a randomised crossover trial. Thorax, 2016. 71(8): p. 759-61.
- Rea, H., et al., The clinical utility of long-term humidification therapy in chronic airway disease. Respir Med, 2010. 104(4): p. 525-33.
- Kohnlein, T., et al., Non-invasive positive pressure ventilation for the treatment of severe stable chronic obstructive pulmonary disease: a prospective, multicentre, randomised, controlled clinical trial. Lancet Respir Med, 2014. 2(9): p. 698-705.
- Murphy, P.B., et al., Effect of Home Noninvasive Ventilation With Oxygen Therapy vs Oxygen Therapy Alone on Hospital Readmission or Death After an Acute COPD Exacerbation: A Randomized Clinical Trial. JAMA, 2017. 317(21): p. 2177-2186.
- Ergan, B., et al., European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J, 2019. 54(3).
- Murphy, P.B., et al., Cost-effectiveness of home non-invasive ventilation in patients with persistent hypercapnia after an acute exacerbation of COPD in the UK. Thorax, 2023. 78(5): p. 523-525.
- Murphy, P.B. and N. Hart, Home Non-Invasive Ventilation for COPD: How, Who and When? Arch Bronconeumol (Engl Ed), 2018. 54(3): p. 149-154.
- Windisch, W., J.H. Storre, and T. Kohnlein, Nocturnal non-invasive positive pressure ventilation for COPD. Expert Rev Respir Med, 2015. 9(3): p. 295-308.
- Duiverman, M.L., et al., Home initiation of chronic non-invasive ventilation in COPD patients with chronic hypercapnic respiratory failure: a randomised controlled trial. Thorax, 2020. 75(3): p. 244-252.
- Halpin, D.M.G., et al., It is time for the world to take COPD seriously: a statement from the GOLD board of directors. Eur Respir J, 2019. 54(1).